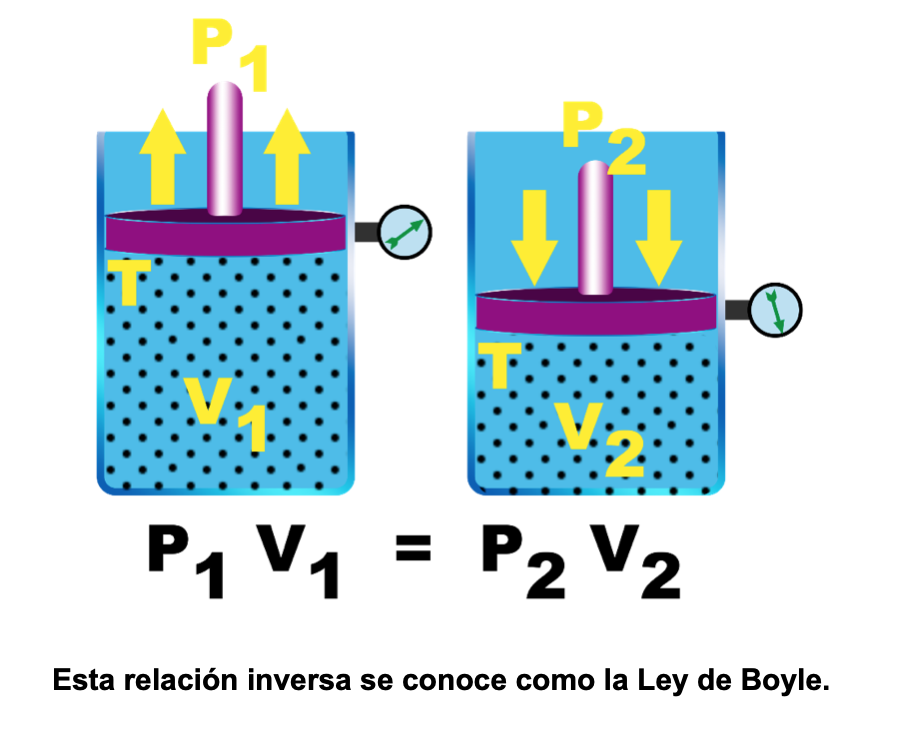
La Ley de Boyle, establece la relación entre el volumen y la presión de una cantidad de gas a una temperatura constante.
El comportamiento físico de un gas se describe mediante cuatro variables, estas son: presión, volumen, temperatura y cantidad (mol).
La investigación de Robert Boyle detalla el comportamiento de un gas ideal, y los resultados de sus experimentos fueron publicados en el año de 1662.
Demostrando que, a temperatura constante, si disminuye el volumen de un gas, la presión aumentará, y si aumenta el volumen, la presión disminuirá.
La Ley de Boyle es una de las leyes básicas de los gases ideales y sienta las bases para comprender otros conceptos importantes en la física y la química.
Experimento de Robert Boyle
En sus experimentos, el investigador utilizó un tubo de vidrio cerrado en un extremo y abierto en el otro, que llenó parcialmente con mercurio y determinó el volumen de gas atrapado.
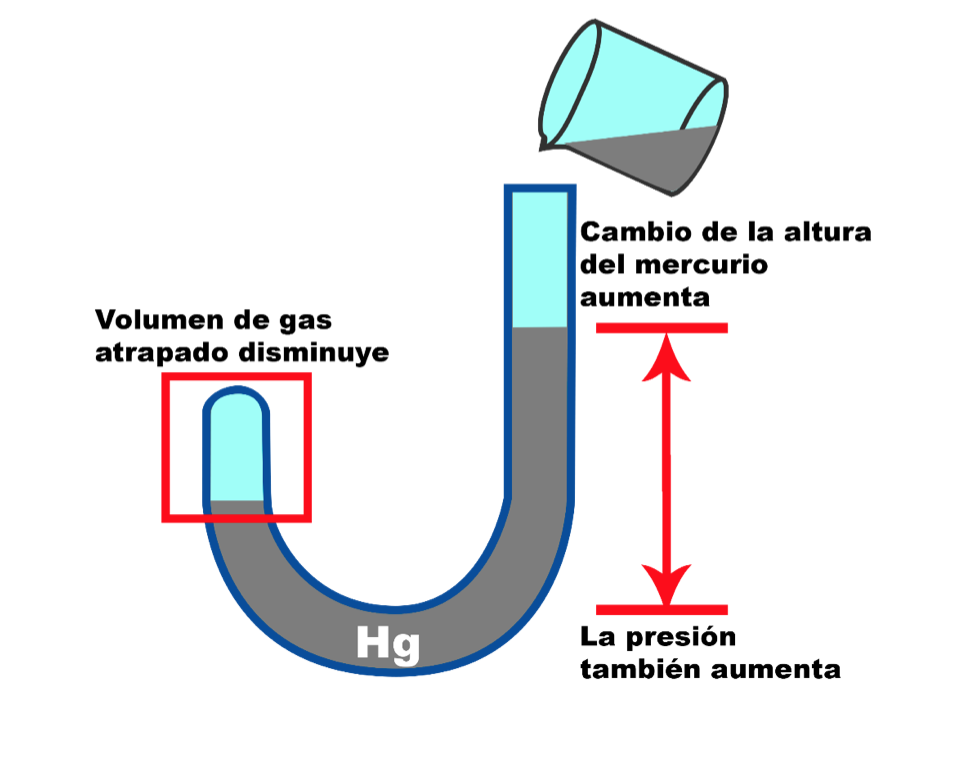
A medida que Boyle variaba la cantidad de mercurio en el espacio de aire del tubo, observó que la altura de la columna de mercurio en el tubo también cambiaba.
Descubrió que cuando el volumen del espacio de aire disminuía, la columna de mercurio aumentaba, y cuando el volumen del espacio de aire aumentaba, la columna de mercurio disminuía.
De esta manera, llegó a la conclusión de que existe una relación inversa entre la presión (la altura de la columna de mercurio) y el volumen del gas contenido en el tubo, siempre y cuando la temperatura se mantenga constante.
Fórmula de la ley de Boyle
Matemáticamente, la ley de Boyle se puede escribir como ![]() , donde «P» es la presión del gas, «V» es el volumen del gas y «k» es una constante.
, donde «P» es la presión del gas, «V» es el volumen del gas y «k» es una constante.
Si se tiene un gas bajo dos condiciones diferentes, entonces; se puede escribir la fórmula como:
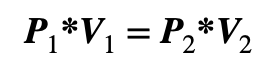
Donde:
![]() representa la presión inicial del gas.
representa la presión inicial del gas.
![]() representa el volumen inicial del gas.
representa el volumen inicial del gas.
![]() representa la presión final del gas.
representa la presión final del gas.
![]() representa el volumen final del gas.
representa el volumen final del gas.
En la fórmula se puede observar que, bajo una determinada condición del gas, si la temperatura se mantiene constante, el producto de la presión y el volumen del gas inicial y final, también se mantiene constante.
Cálculo de las Variables y Unidades de Medida

En el Sistema Internacional de Medidas (SI) las medidas de las variables involucradas en la Ley de Boyle son las siguiente:
- La temperatura se expresa en kelvin (K), aunque también se mide en grados centígrados (°C).
- La presión se mide en pascales (Pa), aunque también se mide en atmósferas (atm) y en milímetros de mercurio (mm Hg). También se puede expresar en torr.
- El volumen se expresa en metros cúbicos (m3), aunque también se mide en litros (L).
Aplicaciones de la Ley de Boyle
Son diversas las aplicaciones en situaciones prácticas de esta ley, desde la producción de gases industriales hasta la terapia de oxígeno en medicina.
- Jeringas médicas: Al presionar el émbolo de la jeringa, se reduce el volumen del espacio en el cilindro de la jeringa, lo que aumenta la presión y permite que el líquido sea administrado con precisión.
- Aplicaciones en la industria química: En la industria química se utiliza en la fabricación y el envasado de productos químicos y gases. Se controla la presión y el volumen para garantizar la seguridad y la eficiencia de los procesos.
- Efectos en la respiración: Cuando se inhala y exhala, también se experimenta la Ley de Boyle. Durante la inhalación, aumenta el volumen de los pulmones, lo que reduce la presión interna y permite que el aire fluya hacia los pulmones. Durante la exhalación, disminuye el volumen de los pulmones, lo que aumenta la presión y expulsa el aire.
Relación de algunas unidades de presión
- 1 atmósfera (atm) = 760 milímetros de mercurio (mm Hg)
- 1 atmósfera (atm) = 101325 Pascal (Pa)
- 1 Pascal (Pa) = 9.8692×10-6 atmósfera (atm)
- 1 torr = 0.00131579 atmósfera (atm)
- 1 torr = 133. Pascal (Pa)
Ejemplo de aplicación de la Ley de Boyle
Ejemplo: Un recipiente contiene de 90![]() de un gas a una presión de 405300 Pa. ¿Cuál es el volumen que ocuparía en un recipiente si se disminuye la presión a 202650 Pa, manteniéndose la temperatura constante?
de un gas a una presión de 405300 Pa. ¿Cuál es el volumen que ocuparía en un recipiente si se disminuye la presión a 202650 Pa, manteniéndose la temperatura constante?
Solución: Se tiene los siguientes datos:

La fórmula para hallar la variable del volumen final es:
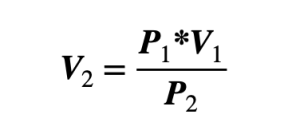
Sustituyendo los valores y resolviendo se obtiene:
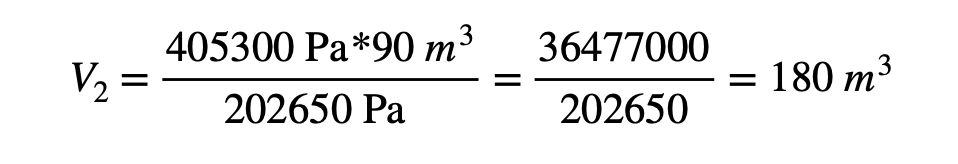
En volumen final del gas en el recipiente a una temperatura constante es de 180 ![]()