La Ley de Charles relaciona el volumen de un gas con su temperatura a una presión constante.
Esta ley es también conocida como “Ley de volúmenes” establece que, a presión constante, el volumen de una masa fija de gas es directamente proporcional a su temperatura absoluta en kelvin.
![]()
En otras palabras, si se mantiene constante la presión de un gas y aumenta su temperatura, su volumen también aumentará, y viceversa.
La ley fue formulada en el año 1780 por el físico francés Jacques Charles, quien, junto con otros científicos notables de su tiempo, estaba inmerso en la exploración de las propiedades de los gases y buscaba establecer leyes matemáticas que describran su comportamiento.
Fue en este contexto que Jacques Charles realizó sus contribuciones cruciales y de allí que, es una de las leyes especiales que permite el estudio de los gases ideales.
En este caso particular, la variación proporcional de volumen y temperatura a presión constante.
Ejemplo Práctico
Se puede imaginar un globo inflado en un día caluroso. A medida que la temperatura aumenta, el gas en el interior del globo se expande, haciendo que el globo aumente de tamaño.
Esto es lo que sucede con un globo aerostático, que se eleva, ya que este se expande al calentarse el aire interior.
Ahora, si se enfría el gas, cuando las temperaturas descienden, el globo se contrae, experimentando una disminución en su tamaño.
De allí, por ejemplo, la importancia de verificar la presión de los neumáticos de un vehículo en días fríos.
Esta precaución se extiende a cualquier objeto inflado, reforzando la idea de revisar la presión de los neumáticos durante condiciones climáticas más frías.
Fórmula de la Ley de Charles
Como se ha mencionado la Ley de Charles establece que, para una cantidad de gas a una presión constante, la temperatura y el volumen son directamente proporcionales entre sí.
![]()
De manera matemática, esta ley se expresa como:
![]()
Donde:
- V: es el volumen del gas, medido en litros (L)
- T: es la temperatura medida en grados Kelvin.
- K: es la constante de proporcionalidad.
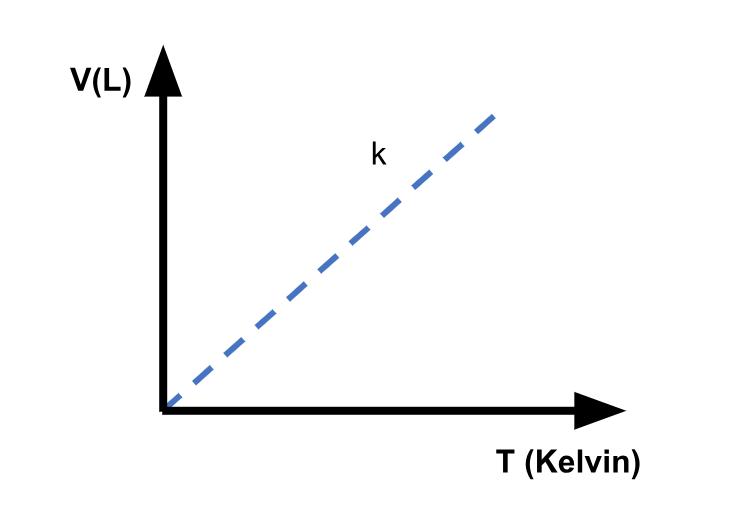
También se puede entender, reacomodando las variables de la fórmula anterior como: “La proporción del volumen (V) sobre la temperatura (T) es una constante (k) distinta de cero.
![]()
La gráfica muestra la relación de Volumen Vs temperatura a una presión y masa constante:
Fórmula para comparar la misma sustancia bajo dos condiciones diferentes
Generalmente, se utiliza para comparar dos situaciones de un gas a presión constante, cuando varía la temperatura o el volumen.
Entonces, la ecuación que permite comparar el cambio de condiciones de temperatura y volumen que puede experimentar una misma muestra de gas a presión constante es:
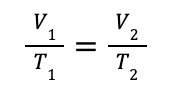
Los subíndices (1) indican las condiciones iniciales y el subíndice (2) las condiciones finales.
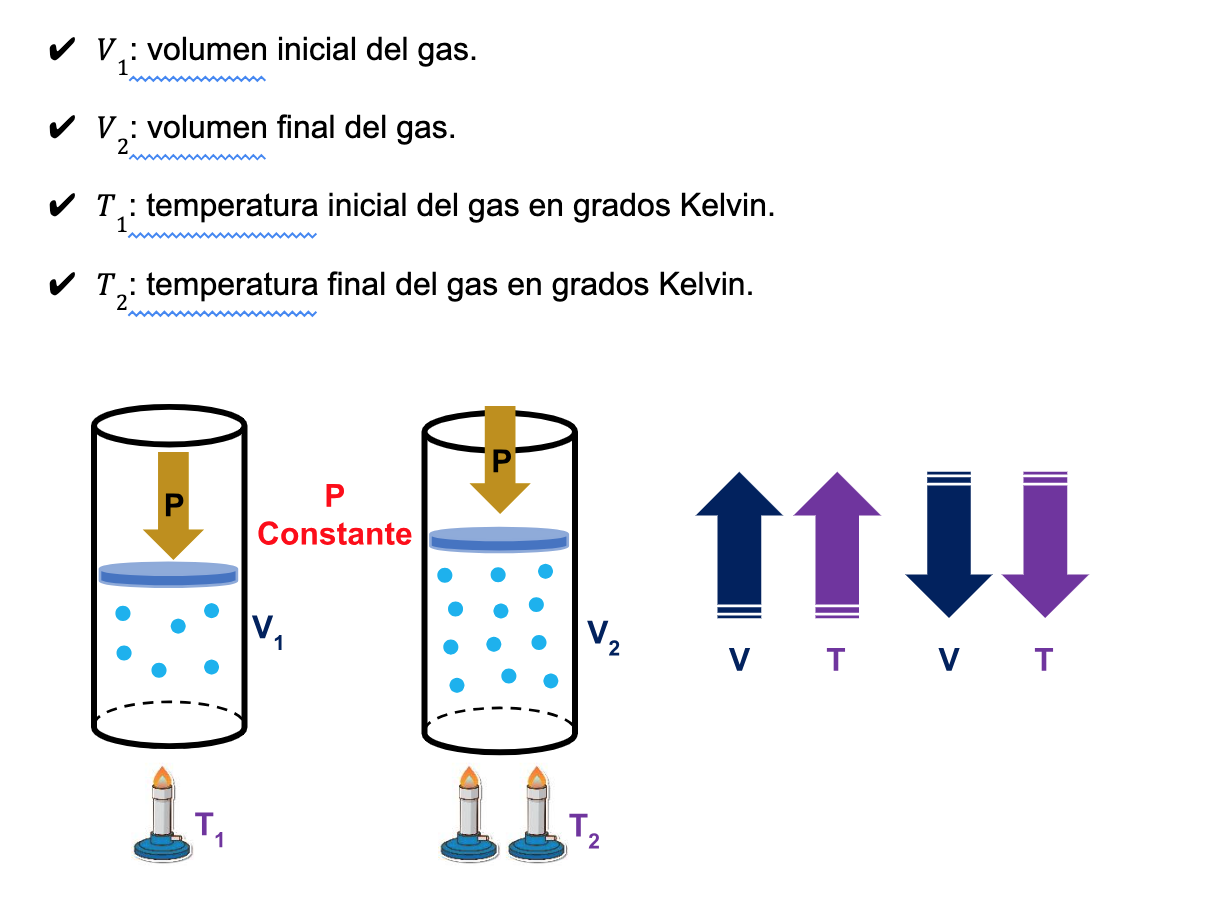
A partir de esta relación matemática, es posible determinar cualquiera de las variables si se conocen las otras tres.
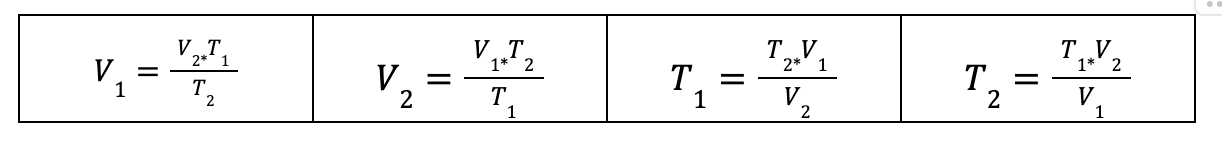
Ejemplo de aplicación de la Ley de Charles
Ejemplo 1: Se tiene inicialmente un gas a una temperatura de 290 K y un volumen de 3L. Si se eleva la temperatura a 370 K, ¿cuál será el nuevo volumen del gas?
Solución: Se tiene los siguientes datos:
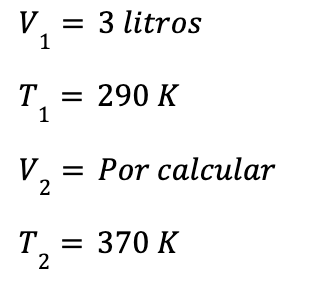
Aplicando la ecuación ya estudiada y sustituyendo los valores conocidos se obtiene:
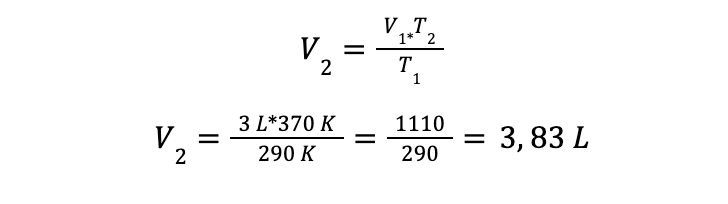
El nuevo volumen del gas al aumentar la temperatura de 290 K a 370 K es de 3,83 litros.
Ejemplo 2: Un gas ocupa un volumen de 0,7 litros a una temperatura de 89°C, ¿Cuál es su temperatura final si su volumen disminuyó a 0,4 L?
Solución: Se tiene los siguientes datos:

Aplicando la ecuación ya estudiada y sustituyendo los valores conocidos se obtiene:
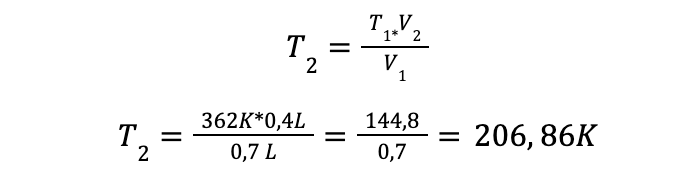
La temperatura final a la que fue sometido el gas fue de 206,86 K